VIMKUNYA
Laboratoire : Bavarian Nordic A/S
Arrêté du 19 décembre 2025 : ce vaccin figure maintenant sur la liste des spécialités agréées à l'usage des collectivités (hôpitaux, cetnres de vaccination...).
Le 27 juin 2025 : recommandations vaccinales pour les voyageurs.
Ce vaccin est disponible en pharmacie depuis le 17 juin 2025.
Contrairement au vaccin IXCHIQ, ce vaccin non vivant à particules pseudovirales peut être utilisé chez toute personne âgée de 12 ans et plus, même en cas d'immunodépression.
Autorisation de mise sur le marché (AMM) européenne obtenue le 28 février 2025.
Description
VIMKUNYA, suspension injectable en seringue préremplie.
Vaccin contre le chikungunya (recombinant, adsorbé) à pseudo-particules virales.
Forme et Présentation
Suspension injectable.
Avant agitation, le vaccin est un liquide limpide contenant un précipité blanc.
pH : 6,6-8,2.
Osmolalité : 320-390 mOsmol/kg.
Nature et contenu de l'emballage extérieur
- 0,8 mL de suspension dans une seringue préremplie unidose constituée d’un corps en verre (de type I), d’un adaptateur Luer-lock (en polycarbonate), d’un capuchon rigide (en polypropylène transparent), d’un bouchon en caoutchouc (mélange isoprène-bromobutyle), d’une tête de piston en caoutchouc (chlorobutyle), d’un piston (en polypropylène blanc) et d’une collerette (en polypropylène blanc).
La seringue préremplie est fournie dans une coque protectrice, conditionnée dans une boîte en carton.
Boîte de 1 seringue préremplie unidose (0,8 mL) sans aiguille.
Composition
1. Antigène
Une dose (0,8 mL) contient 40 microgrammes de pseudo-particules virales1,2 (PPV) apparentées aux protéines du virus du chikungunya (CHIKV) adsorbées sur de l’hydroxyde d’aluminium hydraté.
2 issues de la souche sénégalaise 37997 du CHIKV, constituées d’une protéine de capside (C) et de protéines d’enveloppe E1 et E2 du CHIKV.
2. Autres composants
- Adjuvant : hydroxyde d’aluminium hydraté (environ 300 microgrammes d’Al3+ par dose de 0,8 mL
- Saccharose
- Phosphate dipotassique
- Dihydrogénophosphate de potassium
- Citrate de sodium
- Eau pour préparations injectables
Indications
VIMKUNYA est indiqué dans l’immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) chez les personnes âgées de 12 ans et plus.
Ce vaccin doit être utilisé conformément aux recommandations officielles.
Résumé des recommandations vaccinales pour les voyageurs :
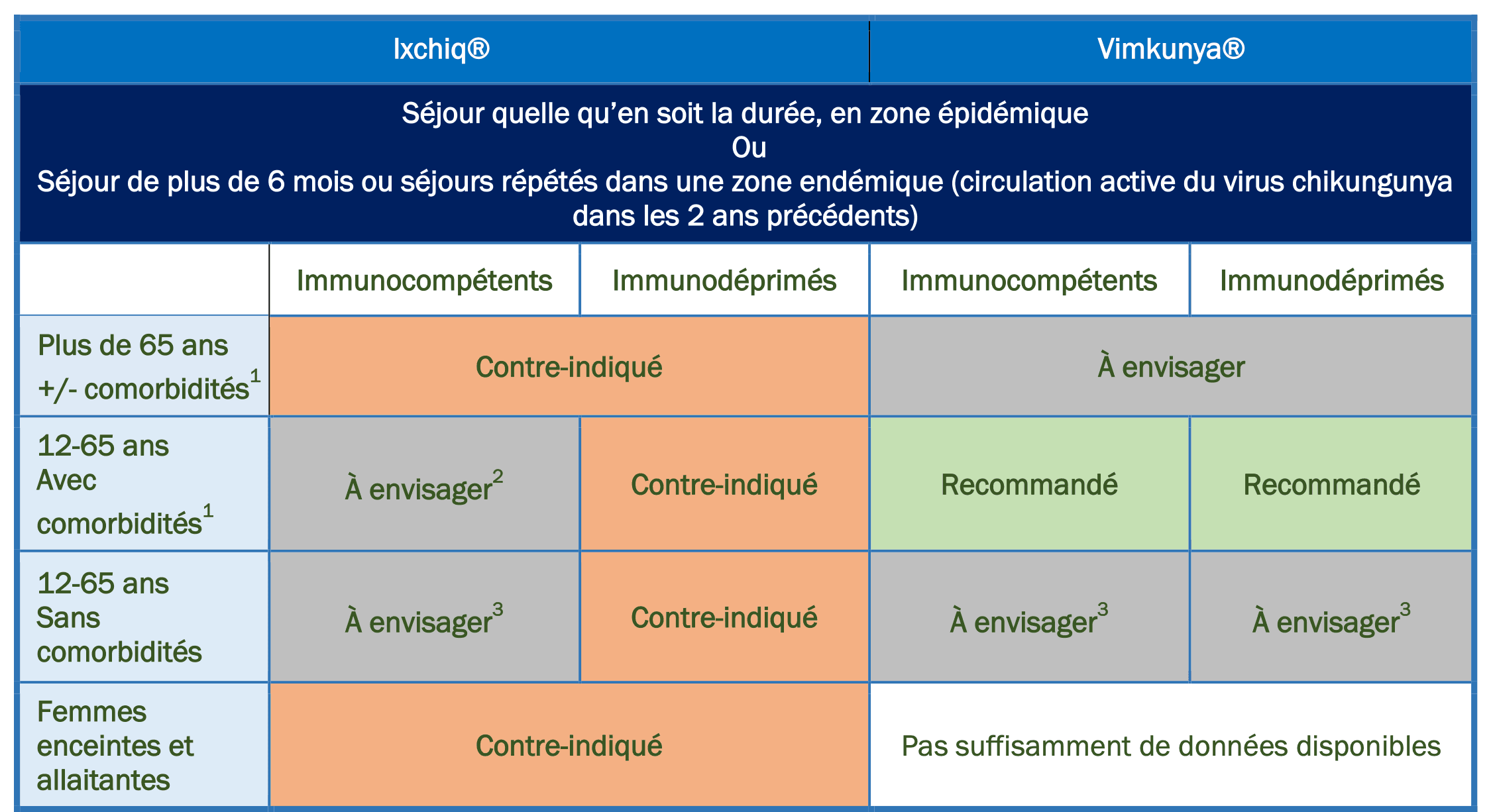
- Comorbidités : hypertension artérielle, diabète, maladies cardiovasculaires, maladies respiratoires, maladies neurovasculaires
- Balance bénéfice/risque à évaluer en tenant compte des effets indésirables rares mais graves observés chez des personnes très âgées et comorbides ; risque ne pouvant pas être complétement exclu chez les personnes de moins de 65 ans très fragiles
médicalement. Les données concernant le profil de tolérance actualisé sont accessibles via le lien suivant :
https://www.adrreports.eu/fr/search.html# - Particulièrement chez les personnes de plus de 45 ans présentant des arthralgies préexistantes et les femmes ayant un projet de grossesse
- Prendre en compte la durée de protection actuellement connue (Ixchiq : 2 ans ; Vimkunya : 6 mois) dans le choix du vaccin.
Posologie
Une dose unique de 0,8 mL doit être administrée.
Personnes âgées
Aucun ajustement de la dose n’est nécessaire chez les personnes âgées de ≥ 65 ans.
Population pédiatrique
La sécurité et l’efficacité de VIMKUNYA chez les enfants âgés de moins de 12 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d'administration
Le vaccin doit être administré en injection intramusculaire (IM) dans le muscle deltoïde.
VIMKUNYA ne doit pas être injecté par voie intraveineuse, intradermique ou sous-cutanée.
La seringue préremplie doit être agitée vigoureusement juste avant utilisation de façon à obtenir une
suspension homogène.
Pour les instructions concernant la manipulation du vaccin et l’élimination des déchets, voir la rubrique correspondante.
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés dans la rubrique "Composition".
Mises en garde et précautions d'emploi
Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hypersensibilité et anaphylaxie
Un traitement médical approprié pour la prise en charge des réactions allergiques immédiates doit être tenu à disposition au cas où une réaction anaphylactique aiguë surviendrait après l’administration de VIMKUNYA.
Personnes immunodéprimées
La sécurité et l’efficacité de VIMKUNYA n’ont pas été évaluées chez les patients présentant une immunodéficience et ceux utilisant des traitements immunosuppresseurs par voie systémique. On ne sait pas si la réponse induite par la vaccination chez les personnes dont les capacités de réponse immunitaire sont altérées, y compris celles recevant un traitement immunosuppresseur, sera la même que chez les personnes immunocompétentes.
Réactions liées à l’anxiété
Comme avec tout vaccin injectable, des réactions liées à l’anxiété, y compris des réactions vaso-vagales (syncope), une hyperventilation ou des réactions liées au stress, peuvent se produire en association avec la vaccination, reflétant une réponse psychogène à l’injection avec une aiguille. Il est important de prendre des précautions pour éviter toute blessure en cas d’évanouissement.
Maladie concomitante
La vaccination doit être reportée chez les personnes présentant une maladie fébrile aiguë sévère ou une infection aiguë. La présence d’une infection mineure et/ou d’une faible fièvre ne doit pas retarder la vaccination.
Thrombocytopénie et troubles de la coagulation
Comme avec les autres injections intramusculaires, le vaccin doit être administré avec précaution aux personnes recevant un traitement anticoagulant ou celles présentant une thrombopénie ou un quelconque trouble de la coagulation (tel qu’une hémophilie) car des saignements ou des ecchymoses pourraient survenir après une injection intramusculaire chez ces personnes.
Limites d’efficacité du vaccin
Comme avec tout vaccin, la réponse protectrice peut ne pas être obtenue chez toutes les personnes après la vaccination. Il est recommandé de continuer à prendre des mesures de protection individuelle contre les piqûres de moustique après la vaccination.
Excipients
Potassium : ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c.-à-d. qu’il est essentiellement « sans potassium ».
Sodium : ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
Interactions
Aucune étude d’interaction avec d’autres médicaments n’a été réalisée.
L’administration concomitante de VIMKUNYA avec d’autres vaccins n’a pas été étudiée.
Fertilité
Aucune étude spécifique n’a été réalisée concernant la fertilité.
Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la fertilité des femelles (voir rubrique "Autres informations / Données de sécurité préclinique").
Grossesse
Lors des études effectuées chez l’animal, aucun effet lié au vaccin sur le développement embryo-fœtal n’a été observé chez le rat et le lapin ; certains effets post-natals, dont la pertinence clinique n’est pas connue, ont été observés chez le lapin uniquement (voir rubrique "Autres informations / Données de sécurité préclinique").
Il existe des données limitées sur l’utilisation de VIMKUNYA chez la femme enceinte. Ces données sont insuffisantes pour permettre de conclure sur l’absence d’effets potentiels de VIMKUNYA sur la grossesse, le développement embryofœtal, l’accouchement et le développement post-natal.
La décision d’administrer VIMKUNYA pendant la grossesse devra être prise en tenant compte du risque individuel d’exposition au CHIKV de type sauvage, de l’âge gestationnel et des risques pour le fœtus ou le nouveau-né.
Allaitement
On ne sait pas si VIMKUNYA est excrété dans le lait maternel. Un risque pour l’enfant allaité ne peut être exclu. Les bénéfices de l’allaitement pour le développement et la santé de l’enfant devront être pris en compte en regard de la nécessité clinique d’utiliser VIMKUNYA chez la mère et des effets indésirables éventuels de VIMKUNYA chez l’enfant allaité.
Effets indésirables
1. Résumé du profil de sécurité
La plus fréquente réaction indésirable locale après l’administration du vaccin a été la douleur au site d’injection (24,0 %). Les réactions indésirables systémiques les plus fréquemment observées après la vaccination ont été la fatigue (17,8 %), les céphalées (16,7 %) et la myalgie (16,5 %).
2. Tableau récapitulatif des effets indésirables
Le tableau résumé des effets indésirables après administration de VIMKUNYA (tableau 1) s’appuie sur l’analyse des données de tolérance groupées issues de trois études de phase II terminées et de deux études de phase III terminées, menées chez 3 522 participants âgés de ≥ 12 ans ayant reçu VIMKUNYA. Parmi ces derniers, 3 141 personnes ont reçu une dose unique de 40 microgrammes de VIMKUNYA. Ces participants ont été suivis afin de détecter la survenue d’événements indésirables graves pendant toute la durée de l’étude, à savoir 182 jours.
Les effets indésirables sont présentés par classe de système d’organes MedDRA en utilisant les termes préférentiels MedDRA. Les effets indésirables rapportés sont classés selon les fréquences suivantes :
- Très fréquent : ≥ 1/10
- Fréquent : ≥ 1/100, < 1/10
- Peu fréquent : ≥ 1/1 000, < 1/100
- Rare : ≥ 1/10 000, < 1/1 000
- Très rare : < 1/10 000
2.1. Effets indésirables rapportés après administration de VIMKUNYA
Troubles généraux et anomalies au site d’administration
- Très fréquent : douleur au site d’injection, fatigue.
- Fréquent : frissons, malaise.
- Peu fréquent : rougeur au site d’injection, gonflement au site d’injection, fièvre, écchymose au site d’injection.
Affections du système nerveux
- Très fréquent : céphalées.
- Peu fréquent : sensation vertigineuse.
- Rare : paresthésie.
Affections musculosquelettiques et du tissu conjonctif
- Très fréquent : myalgie.
- Fréquent : arthralgie.
- Rare : douleur dans les extrémités.
Affections gastro-intestinales
- Fréquent : Nausées.
- Rare : diarrhée, gonflement des lèvres.
Affections hématologiques et du système lymphatique
- Rare : lymphadénopathie.
Infections et infestations
- Rare : gastro-entérite.
Affections respiratoires, thoraciques et médiastinales
- Peu fréquent : congestion nasale.
- Rare : douleur oropharyngée, rhinorrhée.
Affections de la peau et du tissu sous-cutané
- Peu fréquent : rash.
2.2. Population pédiatrique - adolescents
Parmi les 3 522 participants aux études cliniques ayant reçu VIMKUNYA, 6,2 % (n = 217) étaient âgés de 12 à < 18 ans et ont reçu une dose de 40 microgrammes de VIMKUNYA, avec un suivi de 182 jours. Chez les adolescents, le profil de sécurité est similaire au profil de sécurité global observé chez les adultes.
3. Surdosage
Aucun cas de surdosage n’a été rapporté au cours des études cliniques. En cas de surdosage, une surveillance des fonctions vitales et un éventuel traitement symptomatique sont recommandés.
4. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Aucune étude n’a été réalisée concernant les effets sur l’aptitude à conduire des véhicules ou à utiliser des machines. Cependant, certains des effets mentionnés dans la rubrique 4.8 « Effets indésirables » pourraient altérer temporairement l’aptitude à conduire des véhicules ou à utiliser des machines.
5. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration – voir Annexe V.
Pharmacodynamie
Classe pharmacothérapeutique : autres vaccins viraux.
Code ATC : non encore attribué
Mécanisme d’action
VIMKUNYA est un vaccin protéique recombinant à base de pseudo-particules virales (VLP pour Virus Like Particles) contenant un adjuvant. Les VLP ne peuvent pas infecter les cellules, se répliquer ni provoquer la maladie. Le mécanisme exact de protection contre l’infection par le virus CHIKV et/ou la maladie associée n’a pas été établi. Il semble que VIMKUNYA soit capable d’induire une protection contre l’infection par CHIKV en induisant des anticorps neutralisants contre les
protéines C, E1 et E2 du CHIKV contenues dans VIMKUNYA, entraînant une neutralisation du virus vivant. Un adjuvant est ajouté afin d’amplifier la réponse immunitaire induite par le vaccin.
Immunogénicité
Aucune donnée d’efficacité n’est disponible pour VIMKUNYA. L’efficacité clinique a été extrapolée à partir d’une valeur seuil du titre d’anticorps neutralisants contre le CHIKV après vaccination. Une valeur seuil du titre d’anticorps neutralisants sériques (ANS) anti-CHIKV ≥ 100, assurant 80 % de neutralisation du CHIKV, tel que mesurée par un test de neutralisation in vitro, a été retenue comme marqueur de substitution pouvant prédire la protection contre la maladie causée par le CHIKV, et définie comme une séroréponse. Ce seuil a été déterminé sur la base d’une étude séro- épidémiologique prospective menée chez des individus précédemment exposés au CHIKV et d’une étude de transfert passif/challenge chez des primates non humains (PNH) utilisant des sérums poolés
de participants vaccinés par VIMKUNYA.
L’immunogénicité d’une dose unique de 40 microgrammes de VIMKUNYA a été évaluée au cours de deux études pivots menées aux États-Unis : une étude clinique de phase III chez des adolescents et des adultes âgés de 12 à < 65 ans (étude 1) et une étude clinique de phase III chez des adultes âgés de
≥ 65 ans (étude 2). Les participants des deux études de phase III ont été suivis pendant 6 mois après la vaccination. La différence de taux de séroréponse en ANS anti-CHIKV (vaccin VIMKUNYA moins placebo) et la moyenne géométrique des titres (MGT) d’ANS anti-CHIKV à 21 jours après la vaccination (visite du jour 22 de l’étude) étaient les co-critères d’évaluation principaux. Le taux de séroréponse (TSR) était défini comme le pourcentage de personnes ayant obtenu un titre NT80 d’ANS anti-CHIKV ≥ 100. Les personnes immunodéprimées et celles ayant reçu des traitements immunosuppresseurs dans les 6 mois précédant la phase de sélection ont été exclues des études.
Étude 1
Il s’agit de l’étude pivot de phase III, randomisée, multicentrique, contrôlée contre placebo, en double aveugle, avec groupes parallèles, menée aux États-Unis. Au total, 3 258 volontaires sains âgés de 12 à < 65 ans (âge moyen : 39 ans [intervalle : 12 à 64 ans]) ont été randomisés selon un rapport 2:2:2:1 au sein de chaque tranche d’âge (12 à < 18 ans [n = 254 ; 7,8 %], 18 à < 46 ans [n = 1 906 ; 58,5 %] et 46 à < 65 ans [n = 1 098 ; 33,7 %]) pour recevoir soit une dose unique de 40 microgrammes par voie intramusculaire d’un des trois lots de VIMKUNYA en seringue préremplie fabriqués de façon consécutive, soit le placebo. Parmi les sujets randomisés, 1 591 (48,8 %) étaient de sexe masculin et 1 667 (51,2 %) étaient de sexe féminin. À l’inclusion, 69 participants étaient séropositifs (titre d’anticorps anti-CHIKV ≥ 15 [≥ limite inférieure de quantification (LIQ) du test] au Jour 1 avant la vaccination), dont 63 dans le groupe VIMKUNYA et 6 dans le groupe placebo.
La réponse immunitaire chez 2 559 participants (population évaluable pour l’immunogénicité [PEI]) ayant reçu VIMKUNYA et chez 424 participants ayant reçu le placebo a été analysée. Tous les participants de la PEI étaient séronégatifs pour les anticorps neutralisants anti-CHIKV à l’inclusion (avant la vaccination). La comparaison de la réponse en ANS anti-CHIKV entre VIMKUNYA et le placebo, lors des visites aux jours 8, 15, 22 et 183, mesurée d’après la différence cliniquement pertinente entre les taux de séroréponse et les MGT, est présentée dans le tableau 1 et le tableau 2.
Tableau 1 : Taux de séroréponse (TSR) en ANS anti-CHIKV lors des visites aux jours 8, 15, 22 et 183 dans l’étude 1 de phase III (âge de 12 à < 65 ans) (population évaluable pour l’immunogénicité)

a « n » est le nombre de participants présentant un taux de séroréponse dont le titre d’ANS ≥ 100, divisé par « N », le nombre total de participants dans le groupe.
b Les IC à 95 % des taux de séroréponse sont basés sur la méthode de Wilson.
c La différence entre les taux de séroréponse correspond à [VIMKUNYA moins placebo] ; les IC à 95 % sont basés sur la méthode du score hybride de Newcombe. Supériorité statistique par rapport au placebo et borne inférieure de l’IC bilatéral à 95 % pour la différence de taux de séroréponse entre le groupe VIMKUNYA et le groupe placebo ≥ 70 % (considérée comme cliniquement significative).
d La valeur de p est issue d’un test bilatéral du χ² pour le test d’égalité des pourcentages de séroréponse entre les
groupes.
Tableau 2 : Moyennes géométriques des titres (MGT) d’ANS anti-CHIKV lors des visites aux jours 8, 15, 22 et 183 dans l’étude 1 de phase III (âge de 12 à < 65 ans) (population évaluable pour l’immunogénicité)

Pour les MGT, lorsque les valeurs se situaient en dessous de la limite inférieure de quantification (LIQ) de 15, une valeur de LIQ/2 = 7,5 a été attribuée.
PEI : participants exposés ne présentant pas d’ANS anti-CHIKV mesurables au jour 1, pour lesquels un échantillon sérique évaluable était disponible pour l’analyse au jour 22 dans la fenêtre d’analyse prévue (jours 19 à 27 inclus), et n’ayant fait l’objet d’aucun écart au protocole justifiant une exclusion selon les critères
définis avant le gel de la base de données ou la levée de l’aveugle (selon le cas applicable).
a Les jours 8, 15, 22 et 183 correspondent respectivement aux jours 7, 14, 21 et 182 post-vaccination par VIMKUNYA.
b « n » est le nombre de participants pour lesquels un résultat d’analyse d’échantillon était disponible lors de la visite indiquée.
c Les estimations des moyennes géométriques des titres, ainsi que les IC à 95 % correspondants, sont issus d’un modèle ANOVA incluant le centre d’étude et le groupe de traitement comme effets fixes, en supposant une normalité des titres logarithmiques. Le ratio des MGT et les IC à 95 % sont issus du même modèle. La valeur de p teste l’équivalence de la MGT du groupe sur l’échelle logarithmique (ratio des MGT égal à 1).
d Valeur nominale de p (les ajustements formels pour comparaisons multiples n’ont pas été appliqués).
Étude 2
Il s’agit d’une étude de phase III, randomisée, contrôlée contre placebo, en double aveugle, avec groupes parallèles, comportant deux groupes de traitement (VIMKUNYA ou placebo). Cette étude multicentrique a été menée aux États-Unis et a inclus 413 volontaires sains âgés de ≥ 65 ans. Les participants ont été randomisés selon un rapport 1:1 pour recevoir soit une dose unique de 40 microgrammes de VIMKUNYA, soit un placebo. La population cible était constituée d’adultes âgés de ≥ 65 ans (âge moyen : 71 ans [intervalle : 65 à 95 ans]) et a été stratifiée par sous-groupes d’âge (65 à < 75 ans [n = 318 ; 77 %] et ≥ 75 ans [n = 95 ; 23 %]). Parmi les sujets randomisés, 171 (41 %) étaient de sexe masculin et 242 (59 %) étaient de sexe féminin. Les participants de cette étude ont été suivis pendant 6 mois après la vaccination. À l’inclusion, 15 participants étaient séropositifs (titre d’anticorps anti-CHIKV ≥ 15 [≥ limite inférieure de quantification (LIQ)] au Jour 1 avant la vaccination), dont 5 dans le groupe VIMKUNYA et 10 dans le groupe placebo. La population évaluable pour l’immunogénicité comprenait 372 participants, dont 189 ayant reçu VIMKUNYA et 183 ayant reçu le placebo. Tous ces participants étaient séronégatifs pour les anticorps neutralisants anti-CHIKV à l’inclusion (avant la vaccination).
La comparaison de la réponse en ANS anti-CHIKV entre VIMKUNYA et le placebo, lors des visites aux jours 15, 22 et 183, mesurée d’après la différence cliniquement pertinente entre les taux de séroréponse et les MGT, est présentée dans le tableau 3 et le tableau 4.
Tableau 3 : Taux de séroréponse (TSR) en ANS anti-CHIKV lors des visites aux jours 15, 22 et 183 dans l’étude 2 de phase III (âge ≥ 65 ans) (population évaluable pour l’immunogénicité)

a « n » est le nombre de participants présentant un taux de séroréponse dont le titre d’ANS ≥ 100, divisé par « N », le nombre total de participants dans le groupe.
b Les IC à 95 % des taux de séroréponse sont basés sur la méthode de Wilson.
c La différence entre les taux de séroréponse correspond à [VIMKUNYA moins placebo] ; les IC à 95 % sont basés sur la méthode du score hybride de Newcombe. Supériorité statistique par rapport au placebo et borne inférieure de l’IC bilatéral à 95 % pour la différence de taux de séroréponse entre le groupe VIMKUNYA et le groupe placebo ≥ 70 % (considérée comme cliniquement significative).
d La valeur de p est issue d’un test bilatéral du χ² pour le test d’égalité des pourcentages de séroréponse entre les groupes.
Tableau 4 : Moyennes géométriques des titres (MGT) d’ANS anti-CHIKV lors des visites aux jours 15, 22 et 183 dans l’étude 2 de phase III (âge ≥ 65 ans) (population évaluable pour l’immunogénicité)
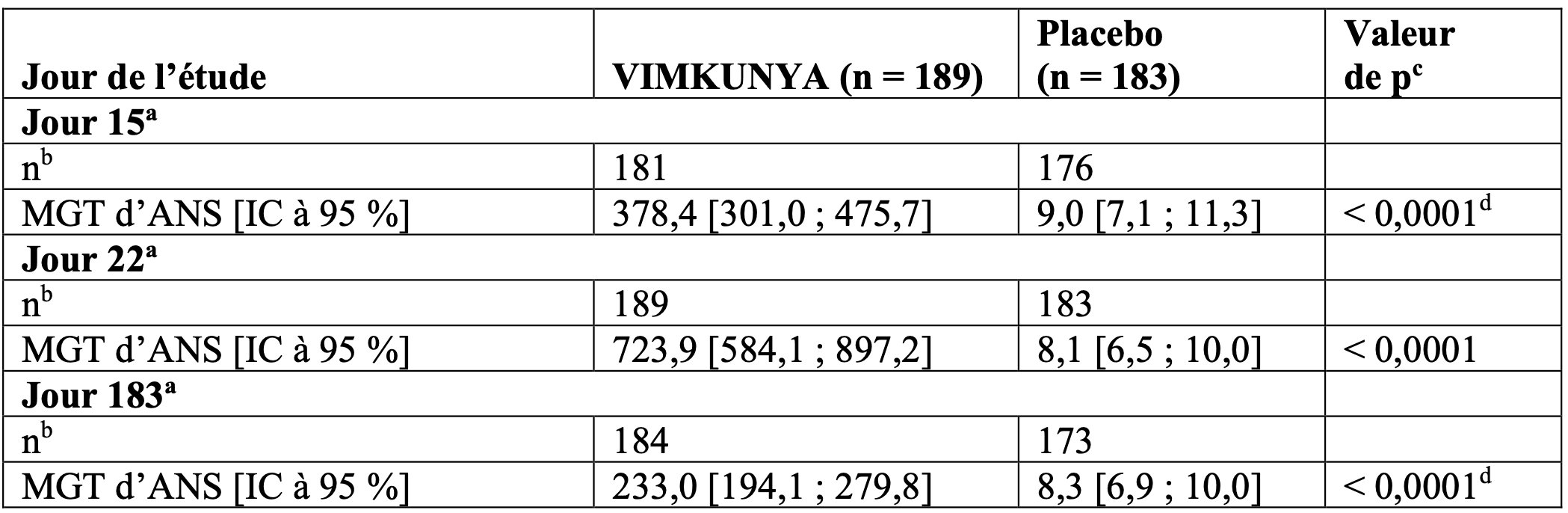
Pour les MGT, lorsque les valeurs se situaient en dessous de la limite inférieure de quantification (LIQ) de 15, une valeur de LIQ/2 = 7,5 a été attribuée.
PEI : participants exposés ne présentant pas d’ANS anti-CHIKV mesurables au jour 1, pour lesquels un échantillon sérique évaluable était disponible pour l’analyse au jour 22 dans la fenêtre d’analyse prévue (jours 19 à 27 inclus), et n’ayant fait l’objet d’aucun écart au protocole justifiant une exclusion selon les critères définis avant le gel de la base de données ou la levée de l’aveugle (selon le cas applicable).
a Les jours 15, 22 et 183 correspondent respectivement aux jours 14, 21 et 182 post-vaccination par VIMKUNYA.
b « n » est le nombre de participants pour lesquels un résultat d’analyse d’échantillon était disponible lors de la visite indiquée.
c Les estimations des moyennes géométriques des titres, ainsi que les IC à 95 % correspondants, sont issus d’un modèle ANOVA incluant le centre d’étude et le groupe de traitement comme effets fixes, en supposant une normalité des titres logarithmiques. Le ratio des MGT et les IC à 95 % sont issus du même modèle. La valeur de p teste l’équivalence de la MGT du groupe sur l’échelle logarithmique (ratio des MGT égal à 1).
d Valeur nominale de p (les ajustements formels pour comparaisons multiples n’ont pas été appliqués).
Au cours des études de phase III (étude 1, étude 2), dans les différents groupes d’âge, les taux de séroréponse (titre NT80 d’ANS anti-CHIKV ≥ 100) et les MGT mesurés dans le groupe VIMKUNYA au jour 22 (21 jours post-vaccination) ont été les suivants : 12 à < 18 ans : 97,0 %, MGT à 2 502 ; 18 à < 46 ans : 98,3 %, MGT à 1 878 ; 46 à < 65 ans : 97,2 %, MGT à 1 175 ; ≥ 65 à < 75 ans : 87,9 %, MGT à 726 ; et ≥ 75 ans : 85,0 %, MGT à 716.
Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec VIMKUNYA dans un ou plusieurs sous-groupes de la population pédiatrique dans le cadre de l’immunisation active pour prévenir la maladie causée par le virus du chikungunya (CHIKV) (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Conservation
Durée de conservation : 3 ans.
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver la seringue dans l’emballage extérieur, à l’abri de la lumière.
Les données de stabilité indiquent que le vaccin reste stable pendant 4 heures lorsqu’il est conservé à une température comprise entre 8 °C et 25 °C et pendant au moins 24 heures lorsqu’il est conservé entre 0 °C et 2 °C. À l’issue de ce délai, VIMKUNYA doit être utilisé immédiatement ou être éliminé. Ces données sont fournies uniquement pour guider les professionnels de la santé en cas d’excursion temporaire de température.
Manipulation
Tenir ce vaccin hors de la vue et de la portée des enfants.
Instructions de manipulation et administration
Le vaccin doit être manipulé par un professionnel de la santé en utilisant une technique aseptique afin de préserver la stérilité de la dose.
Ne pas mélanger VIMKUNYA avec un autre vaccin dans la même seringue ou le même flacon.
Préparation avant utilisation
Sortir la boîte de vaccin du réfrigérateur (entre 2 °C et 8 °C).

Inspecter la seringue préremplie
- Sortir de la boîte la coque contenant la seringue préremplie.
- Retirer la seringue préremplie de la coque en la tenant par le corps.
- Inspecter la seringue préremplie pour vérifier l’absence de fuite ou d’aspect anormal. Si le moindre défaut est constaté, la seringue préremplie ne doit pas être utilisée.
- Avant agitation, VIMKUNYA est un liquide limpide contenant un précipité blanc.
- Agiter vigoureusement la seringue préremplie juste avant utilisation de façon à obtenir une suspension homogène. Après agitation, la suspension doit avoir l’aspect d’un liquide trouble, de couleur blanche, sans particules étrangères visibles. Inspecter la suspension pour vérifier l’absence de particules et de couleur anormale. Ne pas administrer le vaccin si l’une de ces anomalies est présente.
Administrer le vaccin
- Tenir le corps de la seringue préremplie avec l’embout pointé vers le haut et dévisser délicatement le capuchon Luer-lock de la seringue préremplie. Ne pas tenter de retirer le capuchon en le cassant ou en tirant dessus car cela pourrait endommager la seringue.
- Cet emballage ne contient pas d’aiguille. Utiliser une aiguille stérile de dimension appropriée pour une injection intramusculaire en tenant compte de la taille et du poids du patient.
- Fixer l’aiguille stérile sur la seringue préremplie et vérifier que l’aiguille est solidement en place sur la seringue.
- Après agitation, VIMKUNYA a l’aspect d’une suspension trouble homogène de couleur blanche, sans particules étrangères visibles. Si le vaccin n’a pas l’aspect d’une suspension homogène, agiter vigoureusement la seringue pour remettre le produit en suspension avant administration.
- Administrer la dose complète par injection IM dans le muscle deltoïde du haut du bras, en enfonçant doucement le piston et en maintenant la pression sur le piston jusqu’à ce que le contenu de la seringue ait été entièrement expulsé pour que l’injection soit complète.
- VIMKUNYA doit être administré exclusivement par voie IM. Ne pas l’administrer par voie intraveineuse, intradermique ou sous-cutanée.
- Une fois la seringue préremplie sortie du réfrigérateur (entre 2 °C et 8 °C), l’injection doit être administrée dans les 4 heures.
- Les données de stabilité en cours d’utilisation indiquent que le vaccin reste stable pendant 4 heures lorsqu’il est conservé à une température comprise entre 8 °C et 25 °C et pendant au moins 24 heures lorsqu’il est conservé entre 0 °C et 2 °C. D’un point de vue microbiologique, le produit doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation avant utilisation relèvent de la responsabilité de l’utilisateur.
Jeter le produit
- Si le vaccin n’est pas utilisé dans les 4 heures après la sortie du réfrigérateur, où il était conservé entre 2 °C et 8 °C, il doit être jeté.
- Jeter la seringue après utilisation.
Élimination
- Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination numérique (version grand public ou professionnelle).
En l’absence d’études de compatibilité, le vaccin ne doit pas être mélangé avec d’autres médicaments.
Autres informations
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée et de tolérance locale n’ont pas révélé de risque particulier pour l’homme.
Toxicité sur les fonctions de reproduction
Des études de toxicologie sur les fonctions de reproduction et de développement ont été réalisées chez des lapines et des rates en administrant plusieurs doses de VIMKUNYA avant l’accouplement et pendant la gestation. Aucun effet indésirable lié au vaccin sur la fertilité des femelles ou le développement embryo-fœtal n’a été observé quelle que soit l’espèce. Une diminution de l’indice de survie postnatale a été observée chez le lapin mais pas chez le rat ; la pertinence de cette observation pour l’être humain n’est pas connue.
Remboursement
Nom remboursé en ville pour l'instant (prix entre 165 € et 180 € TTC).
Inscription sur la liste des médicaments agréés à l'usage des collectivités (arrêté du 19 décembre 2025). La seule indication thérapeutique ouvrant droit à la prise en charge du vaccin VIMKUNYA par l'assurance maladie est l'immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) chez les personnes âgées de 12 ans et plus, conformément aux recommandations du Haut Conseil de la santé publique en vigueur (recommandations sanitaires 2025 aux voyageurs).