IXCHIQ
Laboratoire : Valneva
Mise à jour septembre 2025. La contre-indication temporaire chez les adultes âgés de 65 ans et plus a été levée. En revanche, il n’est toujours pas recommandé de vacciner les personnes de 65 ans et plus avec IXCHIQ en France.
Le 27 juin 2025 : recommandations vaccinales pour les voyageurs.
Mise à jour du 23 mai 2025. Ce vaccin devient contre-indiqué pour les personnes âgées de 65 ans et plus.
Le 26 avril 2025 (ministère de la santé) : en raison d'un risque de maladie vaccinale récemment identifié chez 3 personnes âgées de 80 ans et plus, les personnes âgées de 65 ans et plus (résidents à La Réunion ou à Mayotte et voyageurs à destination d'une zone à risque de chikungunya) ne doivent plus recevoir le vaccin IXCHIQ.
Le vaccin a obtenu son agrément aux collectivités le 11 avril 2025. Ce vaccin peut donc maintenant être référencé dans les centres de vaccinations internationales publics. La TVA appliquée sur ce vaccin passe de 10 % à 2,10 %.
Une campagne de vaccination contre le chikungunya a débuté le 7 avril 2025 à La Réunion étendue à Mayotte le 22 avril 2025. La population éligible a évolué au cours du temps. A ce jour elle concerne uniquement les personnes âgées de 18 à 64 ans présentant des comorbidités ou maladies chroniques (hypertension artérielle, diabète, maladies cardiovasculaires, respiratoires, rénales, hépatiques et neurovasculaires...).
Depuis le 26 avril 2025, elle ne concerne plus les personnes âgées de 65 ans et plus, présentant ou non des comorbidités, en raison d'un risque de maladie vaccinale.
Les personnes éligibles sont invitées à se faire vacciner, sur prescription médicale, auprès d'un médecin, d'un infirmier ou d'un pharmacien d’officine.
Description
Vaccin vivant atténué contre le chikungunya (autre nom : VLA1553).
Forme et Présentation
▼ Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé doivent déclarer tout effet indésirable suspecté. Voir la rubrique "Effets indésirables" pour les modalités de déclaration des effets indésirables.
Poudre et solvant pour solution injectable.
Avant reconstitution, le vaccin lyophilisé est une poudre homogène blanche à légèrement jaunâtre. Le solvant est un liquide clair incolore.
Nature et contenu de l'emballage extérieur
IXCHIQ est fourni dans une boîte contenant :
- Un flacon unidose (verre de type I) contenant la poudre lyophilisée du vaccin avec un bouchon en caoutchouc (bromobutyle) et un capuchon en aluminium avec opercule en polypropylène.
- Une seringue préremplie contenant un solvant composé de 0,5 mL d’eau pour préparation injectable avec un bouchon en caoutchouc (Flurotec®) et un capuchon (bromobutyle) (emballé sans aiguilles).
- Présentation : 1 flacon de poudre, 1 seringue pré-remplie de solvant sans aiguilles.
Présentation sans aiguille, il convient de prescrire/délivrer ce vaccin en associant :
Pour la reconstitution : une aiguille de 22-25 G d’une longueur minimale de 40mm.
Pour l’injection : une aiguille adaptée à l’administration intramusculaire du vaccin.
Composition
Après reconstitution, une dose (0,5 mL) contient :
1. Antigène
- Virus du chikungunya (CHIKV), souche Δ5nsP3 (vivant, atténué)* à pas moins de 3,0 log10 DICT50**.
** Dose infectieuse pour 50 % de la culture tissulaire
Ce produit contient des organismes génétiquement modifiés (OGM).
2. Excipients
2.1 Poudre
- Saccharose
- D-sorbitol
- L-méthionine
- Citrate trisodique dihydraté
- Chlorure de magnésium
- Phosphate dipotassique hydrogéné
- Dihydrogénophosphate de potassium
- Albumine humaine recombinée (rHA) produite sur levure (Saccharomyces cerevisiae)
2.1 Solvant
- Eau pour préparations injectables
Indications
IXCHIQ est indiqué dans l’immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) chez les personnes âgées de 12 ans et plus.
L’utilisation de ce vaccin doit être conforme aux recommandations officielles.
Recommandation vaccinale pour les personnes à risque résidant à La Réunion ou à Mayotte (HAS 2025).
Résumé des recommandations vaccinales pour les voyageurs :
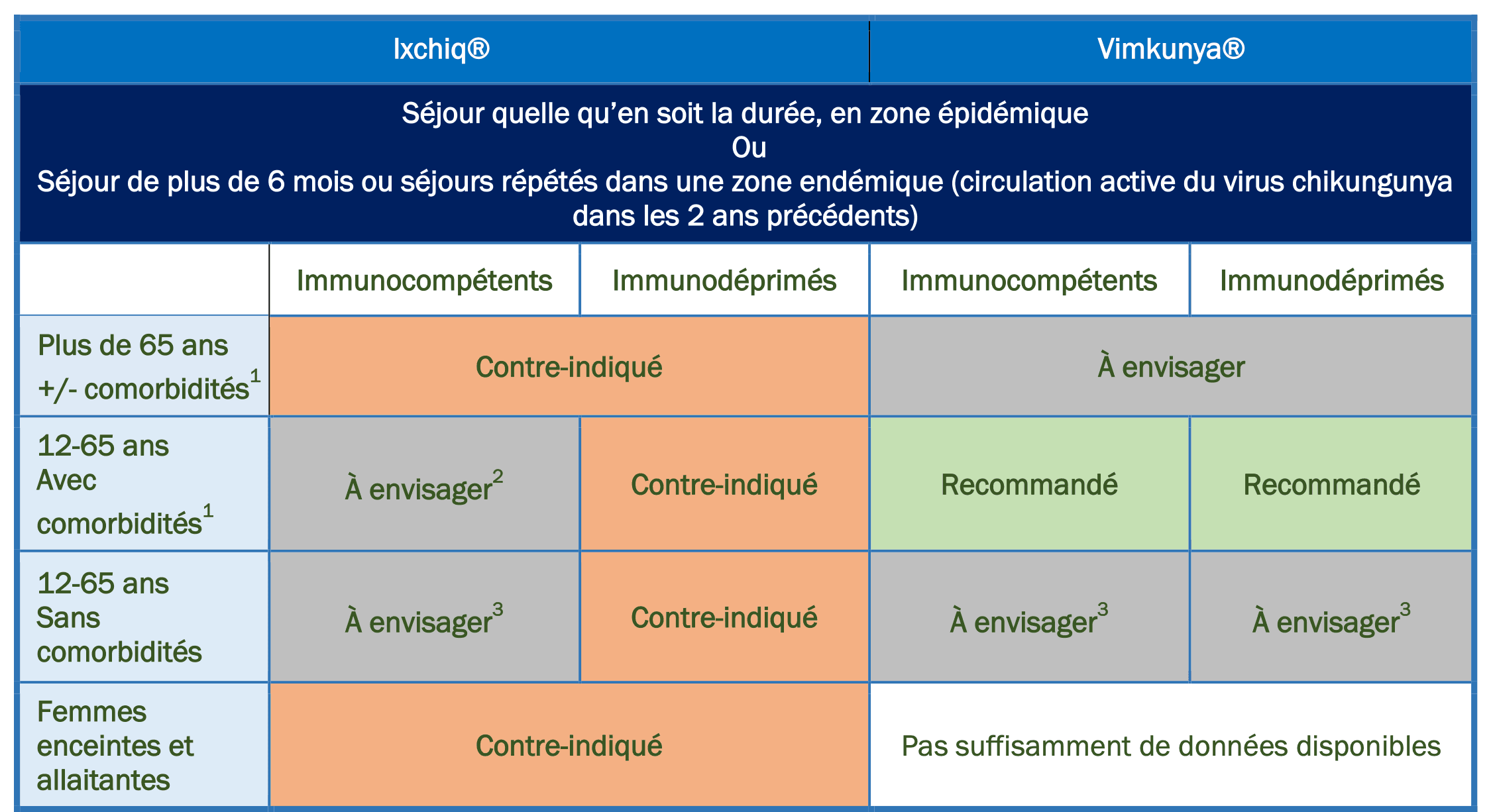
- Comorbidités : hypertension artérielle, diabète, maladies cardiovasculaires, maladies respiratoires, maladies neurovasculaires
- Balance bénéfice/risque à évaluer en tenant compte des effets indésirables rares mais graves observés chez des personnes très âgées et comorbides ; risque ne pouvant pas être complétement exclu chez les personnes de moins de 65 ans très fragiles
médicalement. Les données concernant le profil de tolérance actualisé sont accessibles via le lien suivant :
https://www.adrreports.eu/fr/search.html# - Particulièrement chez les personnes de plus de 45 ans présentant des arthralgies préexistantes et les femmes ayant un projet de grossesse
- Prendre en compte la durée de protection actuellement connue (Ixchiq : 2 ans ; Vimkunya : 6 mois) dans le choix du vaccin.
Posologie
Personnes à partir de 12 ans
IXCHIQ est administré en dose unique de 0,5 mL.
Nouvelle vaccination (dose de rappel)
La nécessité d’une revaccination n’a pas été établie.
Population pédiatrique de moins de 12 ans
La sécurité et l’immunogénicité d’IXCHIQ chez les enfants de moins de 12 ans n’ont pas encore été établies. Aucune donnée n’est disponible chez les enfants âgés de moins de 12 ans.
Mode d'administration
Pour injection intramusculaire uniquement, après reconstitution.
IXCHIQ doit être administré par voie intramusculaire dans le muscle deltoïde dans les 2 heures suivant sa reconstitution.
Le vaccin ne doit pas être mélangé avec d’autres vaccins ou médicaments dans la même seringue. Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique "Manipulation".
Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique "Composition".
Personnes immunodéficientes ou immunodéprimées en raison d’une maladie ou d’un traitement médical (par exemple, en raison d’une tumeur maligne, d’une chimiothérapie, d’un traitement immunosuppresseur, d’une immunodéficience congénitale ou d’une infection par le VIH accompagnée d’une immunodépression sévère).
Mises en garde et précautions d'emploi
IXCHIQ ne devrait être administré qu’en cas de risque significatif d’infection par le chikungunya et après un examen approfondi des bénéfices et des risques potentiels (voir la rubrique " Contre-indications" et ci-dessous).
Des effets indésirables graves ont été signalés suite à l’administration d’IXCHIQ, notamment chez les personnes âgées de 65 ans et plus, et chez celles souffrant de plusieurs affections chroniques sous-jacentes et/ou non contrôlées (voir la rubrique "Effets indésirables"). Une réactogénicité sévère ou des effets indésirables semblables au chikungunya peuvent entraîner une détérioration de l’état de santé général, notamment des malaises et une perte de l’appétit, une exacerbation des affections préexistantes, un état de confusion, une encéphalopathie ou une encéphalite, provoquant des chutes, une hospitalisation et la mort. Les personnes vaccinées doivent être invitées à consulter immédiatement un médecin si elles présentent, après la vaccination, tout symptôme évocateur d’une réactogénicité sévère ou d’effets indésirables semblables au chikungunya.
1. Traçabilité
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
2. Hypersensibilité et anaphylaxie
Il convient de toujours disposer d’un traitement médical approprié et de surveiller le sujet vacciné en cas de réaction anaphylactique après l’administration du vaccin. Une surveillance étroite d’au moins 15 minutes est recommandée après la vaccination.
3. Réactions liées à l’anxiété
Des réactions liées à l’anxiété, y compris des réactions vaso-vagales (syncope), une hyperventilation ou des réactions liées au stress peuvent se produire en association avec la vaccination reflétant une réponse psychogène à l’injection via l’aiguille. Il est important de prendre des précautions pour éviter toute blessure due aux évanouissements.
4. Maladie concomitante
La vaccination doit être reportée chez les personnes souffrant d’une maladie fébrile aiguë sévère ou d’une infection aiguë. La présence d’une infection mineure et/ou d’une fièvre légère ne doit pas retarder la vaccination.
5. Thrombocytopénie et troubles de la coagulation
Le vaccin doit être administré avec précaution aux personnes recevant un traitement anticoagulant ou à celles souffrant de thrombocytopénie ou de tout trouble de la coagulation (tel que l’hémophilie), car des saignements ou des ecchymoses peuvent survenir après une injection intramusculaire chez ces personnes.
6. Limites d’efficacité du vaccin
La capacité d’IXCHIQ à prévenir la maladie causée par le virus du chikungunya a été basée sur un marqueur sérologique de substitution (voir la rubrique "Pharmacodynamie"). Comme avec tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez toutes les personnes après la vaccination. Après vaccination, il est recommandé de poursuivre les mesures de protection individuelle contre les piqûres de moustique.
7. Grossesse
La décision d’administrer IXCHIQ pendant la grossesse doit tenir compte du risque d’exposition de la personne à une infection par CHIKV de type sauvage, de l’âge gestationnel et des risques pour le fœtus ou le nouveau-né d’une transmission verticale du CHIKV de type sauvage.
8. Don du sang
La virémie vaccinale a été détectée chez 90 % des sujets 3 jours après la vaccination. La proportion de personnes vaccinées chez lesquelles le virus était détectable a chuté à 17 %, 7 jours après l’administration d’IXCHIQ, et aucune virémie vaccinale n’a été détectée 15 jours après la vaccination. Voir les rubriques "Effets indésirables".
Les personnes ayant reçu IXCHIQ ne doivent pas donner leur sang pendant au moins 4 semaines après la vaccination.
9. Effets indésirables semblables au chikungunya
IXCHIQ peut provoquer des effets indésirables graves ou prolongés semblables au chikungunya (voir la rubrique "Effets indésirables").
10. Encéphalite
Des cas d'encéphalite (y compris avec une issue fatale) ont été signalés durant l’utilisation post-commercialisation d’IXCHIQ (voir la rubrique "Effets indésirables").
11. Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose. Il est donc essentiellement « sans sodium ».
12. Potassium
Ce médicament contient moins de 1 mmol de potassium (39 mg) par dose. Il est donc essentiellement « sans potassium ».
Ce médicament contient 25 mg de sorbitol par dose de 0,5 mL, ce qui équivaut à 0,036 mg de sorbitol/kg/0,5 mL. L’effet cumulatif des produits coadministrés contenant du sorbitol (ou fructose) et l’apport alimentaire en sorbitol (ou fructose) doit être pris en compte.
Interactions
Administration concomitante avec d’autres vaccins
Il n’est pas recommandé de coadministrer IXCHIQ avec d’autres vaccins car il n’existe aucune donnée relative à la sécurité et à l’immunogénicité suite à l’administration concomitante de IXCHIQ avec d’autres vaccins.
L’administration d’immunoglobulines et les transfusions de sang ou de plasma 3 mois avant et jusqu’à 1 mois après l’administration d’IXCHIQ peuvent interférer avec la réponse immunitaire attendue.
D’une manière générale, tous les vaccins peuvent être administrés le même jour ou à n’importe quel intervalle à l’exception des vaccins vivants viraux qui doivent être administrés le même jour ou à 4 semaines d’intervalle.
Fertilité
Aucune étude spécifique n’a été réalisée sur la fertilité.
Les études effectuées chez l’animal n’ont indiqué aucun effet nocif sur la fertilité des femelles (voir la rubrique "Autres informations / Données de sécurité préclinique").
Grossesse
Les études effectuées chez l’animal n’ont indiqué aucun effet délétère direct ou indirect sur la reproduction (voir la rubrique "Autres informations / Données de sécurité préclinique").
Il existe des données limitées sur l’utilisation de IXCHIQ chez la femme enceinte. Ces données ne sont pas suffisantes pour conclure à l’absence d’effets potentiels de IXCHIQ sur la grossesse, le développement embryonnaire/fœtal, l’accouchement ou le développement post-natal.
La transmission verticale du CHIKV de type sauvage chez les femmes enceintes ayant une virémie au moment de l’accouchement est fréquente et peut provoquer une maladie CHIKV potentiellement fatale chez le nouveau-né. La virémie vaccinale est observée dès la première semaine suivant l’administration de IXCHIQ, puis disparait 14 jours après la vaccination. On ignore si le virus vaccinal peut être transmis verticalement et provoquer des effets indésirables chez le fœtus ou le nouveau-né.
La décision d’administrer IXCHIQ pendant la grossesse doit tenir compte du risque individuel d’exposition au CHIKV de type sauvage, de l’âge gestationnel et du risque de transmission verticale du CHIKV de type sauvage au fœtus ou au nouveau-né.
Allaitement
Il n’existe pas de données sur l’excrétion de IXCHIQ dans le lait maternel. Un risque pour l’enfant allaité ne peut pas être exclu. Les bénéfices de l’allaitement sur le développement et la santé de l’enfant devraient être comparés au benéfice de vacciner la mère avec IXCHIQ et à tout effet indésirable potentiel d’IXCHIQ pouvant survenir chez l’enfant allaité.
Les études effectuées chez l’animal n’ont montré aucun effet nocif direct ou indirect en ce qui concerne l’allaitement (voir la rubrique "Autres informations / Données de sécurité préclinique").
Effets indésirables
1. Résumé du profil de sécurité
1.1. Personnes âgées de 18 et plus
Le profil général de sécurité d’IXCHIQ est basé sur une analyse des données de sécurité regroupées provenant de trois essais cliniques finalisés de phase I et III réalisés aux États-Unis sur 3 610 participants âgés de plus de 18 ans et ayant reçu une dose d’IXCHIQ avec un suivi de 6 mois.
Les réactions les plus fréquentes au site d’injection étaient : sensibilité au toucher (10,8 %) et douleur (6,1 %). Les effets indésirables systémiques les plus fréquents étaient : céphalées (32 %), fatigue (29,4 %), myalgie (23,7 %), arthralgie (16,6 %), fièvre (13,8 %) et nausées (11,4 %).
Dans le cadre de l’utilisation post-commercialisation, des effets indésirables graves ont été signalés chez les hommes âgés de 65 ans et plus souffrant de maladies chroniques sous-jacentes telles qu’une maladie cardiovasculaire, un diabète sucré ou une néphropathie chronique. Ces effets indésirables comprenaient des troubles neurologiques tels qu’une encéphalite fatale, une détérioration de l’état de santé général et une exacerbation des affections chroniques (voir la rubrique "Mises en garde et précautions d'emploi").
1.2. Adolescents âgés de 12 ans à moins de 18 ans
La sécurité chez les adolescents âgés de 12 ans à moins de 18 ans a été évaluée au Brésil chez 502 participants ayant reçu une dose d’IXCHIQ et un suivi de 6 mois. 18,7 % des participants avaient des anticorps préexistants contre le virus du chikungunya (94 adolescents).
Les réactions les plus fréquentes au point de vaccination chez les adolescents de 12 ans à moins de 18 ans étaient une sensibilité (19,9 %) et une douleur (19,3 %). Les effets indésirables systémiques les plus fréquents étaient des céphalées (51,0 %), une myalgie (26,9 %), de la fièvre (24,1 %), de la fatigue (22,3 %), des nausées (15,9 %) et une arthralgie (12,9 %).
1.3. Adolescents séropositifs au départ
La proportion de participants ayant subi des effets indésirables systémiques sollicités était supérieure chez les participants séronégatifs au départ ayant été vaccinés avec IXCHIQ par rapport aux participants séropositifs au départ ayant été vaccinés avec IXCHIQ (67,9 % et 44,7 %, respectivement).
2. Paramètres de laboratoire
2.1. Personnes âgées de 18 et plus
Les paramètres de laboratoire anormaux les plus fréquents étaient : neutropénie (41,8 %), leucopénie (31,2 %), lymphopénie (22,3 %), augmentation de l’alanine aminotransférase (ALAT : 15,5 %) et de l’aspartate aminotransférase (ASAT : 11,7 %) (résultats basés sur l’immunogénicité évaluée dans un sous-groupe de 372 patients ayant reçu IXCHIQ).
2.2. Adolescents de 12 ans à moins de 18 ans
Les paramètres de laboratoire anormaux les plus fréquents étaient une neutropénie (40,2 %), une leucopénie (16,8 %) et une lymphopénie (11,6 %) (résultats basés sur l’immunogénicité évaluée dans un sous-groupe de 328 patients ayant reçu IXCHIQ).
3. Virémie et excrétion du vaccin
Il a été démontré que le virus vaccinal était présent dans le sang et l'urine et qu'il pouvait être présent dans d'autres fluides corporels.. La virémie et l’excrétion du vaccin (mesurées à l’aide des méthodes d’amplification génomique) suivant la vaccination avec IXCHIQ ont été évaluées lors d’un essai clinique (VLA1553-101). Une virémie a été détectée chez 90 % des sujets 3 jours après la vaccination. La proportion de personnes chez lesquelles le virus était détectable a chuté à 17 %, 7 jours après l’administration d’IXCHIQ, et aucune virémie vaccinale n’a été détectée 15 jours après la vaccination. Un seul participant a excrété le virus vaccinal dans ses urines 7 jours après la vaccination.
4 Liste tabulée des effets indésirables chez les personnes de 12 ans et plus
Les effets indésirables sont listés selon les catégories de fréquence suivantes :
- Très fréquents : (≥ 1/10),
- Fréquents : (≥ 1/100 à < 1/10),
- Peu fréquents : (≥ 1/1 000 à < 1/100),
- Rares : (≥ 1/10 000 à < 1/1 000), Très rares : (<1/10 000).
- Non connus : (estimation impossible à partir des données disponibles).
Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Troubles du système sanguin et lymphatique
- Fréquents : lymphadénopathie a.
- Peu fréquents : thrombocytopénie.
Troubles endocriniens
- Rares : hyponatrémie hypovolémique a.
Troubles du système nerveux
- Très fréquents : céphalées.
- Fréquents : étourdissements b.
- Peu fréquents : paresthésie, syncope.
- Rares : état de confusion.
- Non connus : encéphalopathie, encéphalite, méningite aseptique.
Troubles oculaires
- Fréquents : douleurs oculaires b.
- Peu fréquents : Hyperémie conjonctivale c.
Troubles de l’oreille et du conduit auditif
- Peu fréquents : acouphènes a.
Troubles respiratoires, thoraciques et médiastinaux
- Peu fréquents : dyspnée.
Troubles gastro-intestinaux
- Très fréquents : nausées.
- Fréquents : vomissements, diarrhées.
Troubles cutanés et du tissu sous-cutané
- Fréquents : éruption cutanée.
- Peu fréquents : hyperhidrose a.
Troubles musculo- squelettiques et du tissu conjonctif
- Très fréquents : myalgie, arthralgie.
- Fréquents : dorsalgie a.
Troubles généraux et anomalies au point d’administration
- Très fréquents : fatigue, fièvre, réactions au site d’injection (sensibilité au toucher, douleur, érythème, induration, gonflement).
- Fréquents : frissons.
- Peu fréquents : asthénie a, œdème périphériquea , malaise, diminution de l'appétit.
Examens médicaux
- Très fréquents : diminution du nombre de globules blancs d ; résultats élevés aux tests de la fonction hépatique a, e.
b. douleurs oculaires et étourdissements : fréquents chez les adolescents, peu fréquents chez les adultes ;
c. signalé chez les adolescents uniquement, non signalé chez les adultes ;
d. inclut : leucopénie (diminution des leucocytes), neutropénie (diminution des neutrophiles) et lymphopénie (diminution des lymphocytes) ;
e. inclut : augmentation de l’alanine aminotransférase (ALAT) et de l’aspartate aminotransférase (ASAT).
4.1. Effets indésirables semblables au chikungunya
Adultes
La survenue de certains effets indésirables combinés, considérés comme des effets indésirables semblables au chikungunya, a été évaluée rétrospectivement dans les données de sécurité regroupées issues des essais cliniques de phase I et III (N = 3 610). Une définition large des effets indésirables semblables au chikungunya a été établie, à savoir, la survenue d’une fièvre (≥ 38 °C) et au moins de l’un des autres symptômes rapportés lors de la phase aigue du chikungunya, notamment arthralgie ou arthrite, myalgie, céphalées, dorsalgie, éruptions cutanées, lymphadénopathie et certains symptômes neurologiques, cardiaques ou oculaires apparus dans les 30 jours suivant la vaccination, quel que soit le délai d’apparition, la sévérité ou la durée des symptômes individuels.
Les effets indésirables combinés qualifiés comme étant des effets indésirables semblables au chikungunya ont été signalés chez 12,1 % des participants. Parmi ces derniers, la combinaison d’une fièvre avec céphalée, fatigue, myalgie ou arthralgie était la plus fréquente, tous les autres symptômes étant signalés dans moins de 10 % des effets indésirables semblables au chikungunya. Les symptômes signalés étaient généralement légers, avec 1,8 % des participants ayant signalé au moins un symptôme grave, le plus souvent de la fièvre ou une arthralgie. Le délai médian d’apparition de effets indésirables semblables au chikungunya était de 3 jours après la vaccination et le délai médian de résolution était de 4 jours. Des symptômes de plus longue durée ≥ 30 jours sont survenus chez 0,4 % des participants.
Adolescents de 12 ans à moins de 18 ans
La survenue des effets indésirables semblables au chikungunya chez les adolescents (de 12 ans à moins de 18 ans) a été évaluée dans une analyse post-hoc de 502 participants de l’étude de phase III chez les adolescents. Les effets indésirables semblables au chikungunya chez les adolescents ont été définis, à savoir la survenue d’une fièvre (≥ 37,8 °C/100 °F) et au moins de l’un des autres symptômes signalés lors d’un chikungunya au stade aigu, notamment arthralgie ou arthrite, myalgie, céphalées, dorsalgie, ou certains symptômes neurologiques ou oculaires, éruptions cutanées, ou certains symptômes cutanés apparus dans les 30 jours suivant la vaccination, quel que soit le délai d’apparition, la sévérité ou la durée des symptômes individuels. Les effets indésirables semblables au chikungunya ont été signalés chez 23,1 % des adolescents. Parmi ces derniers, la combinaison d’une fièvre avec céphalée, myalgie, fatigue ou arthralgie était la plus fréquente, tous les autres symptômes étant signalés chez moins de 10 % des participants. 3,6 % des participants ont signalé au moins un symptôme grave, le plus souvent de la fièvre ou une céphalée. Le délai médian d’apparition des effets indésirables semblables au chikungunya était de 2 jours après la vaccination et le délai médian de résolution était de 4 jours. Aucun effet indésirable semblable au chikungunya de plus longue durée n’a été signalé chez les adolescents (c’est-à-dire au moins un symptôme d’une durée ≥ 30 jours).
Adolescents séropositifs au départ
La proportion de participants ayant subi des effets indésirables semblables au chikungunya était supérieure chez les participants séronégatif
5. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
IXCHIQ n’a aucun effet ou a un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines. Cependant, certains des effets mentionnés à la rubrique " Effets indésirable" peuvent affecter temporairement l’aptitude à conduire ou à utiliser des machines.
6. Surdosage
Aucun cas de surdosage n’a été rapporté dans les études cliniques. En cas de surdosage, une surveillance des fonctions vitales et un éventuel traitement symptomatique sont recommandés.
7. Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé sont tenus de déclarer tout effet indésirable suspecté via le système national de déclaration – voir Annexe V.
Pharmacodynamie
Classe pharmacothérapeutique : autres vaccins viraux.
Code ATC : non encore attribué.
Janvier 2025. De nouvelles données montrent que les anticorps neutralisants induits par ce vaccin persistent au moins 3 ans.
1. Mécanisme d’action
IXCHIQ contient le CHIKV vivant atténué du génotype ECSA/IOL. Le mécanisme exact de protection contre l’infection par CHIKV et/ou la maladie n’a pas été déterminé. IXCHIQ induit des anticorps neutralisants contre le CHIKV.
2. Immunogénicité
Aucune donnée d’efficacité n’est disponible pour IXCHIQ. L’efficacité clinique d’IXCHIQ a été extrapolée à partir d’une valeur seuil du titre d’anticorps neutralisants contre le CHIKV après vaccination par IXCHIQ.
Une valeur seuil du titre d’anticorps neutralisants anti-CHIKV μPRNT50 ≥ 150 a été retenue comme marqueur de substitution de la protection, et considérée comme une séroréponse. Ce seuil a été défini à partir d’une étude d’immunisation passive chez le primate non-humain au cours de laquelle les animaux avec des titres ≥ 150 étaient protégés contre les infections par CHIKV de type sauvage et n’avaient pas de virus détectable dans le sang pendant les 14 jours suivant l’infection expérimentale. En outre, une étude prospective séro-épidémiologique menée chez l’homme a confirmé ce seuil.
VLA1553-301 est une étude contrôlée versus placebo évaluant l’immunogénicité et la sécurité chez des sujets en bonne santé, âgés de 18 ans et plus. L’étude a été réalisée aux États-Unis. Les participants de l’étude ont été suivis pendant 6 mois après l’immunisation. Le critère principal a été défini comme le pourcentage de participants ayant des titres d’anticorps anti-CHIKV μPRNT50 de ≥ 150, correspondant à un taux de séroréponse, 28 jours après la vaccination des participants négatifs aux anticorps neutralisants anti-CHIKV dans le groupe vacciné par IXCHIQ.
VLA1553-301 est une étude contrôlée versus placebo évaluant l’immunogénicité et la sécurité chez des sujets en bonne santé, âgés de 18 ans et plus. Les participants de l’étude ont été suivis pendant 6 mois après l’immunisation. Le critère principal a été défini comme le pourcentage de participants ayant des titres d’anticorps anti-CHIKV μPRNT50 de ≥ 150, correspondant à un taux de séroréponse, 28 jours après la vaccination dans le groupe vacciné par IXCHIQ.
La réponse immunitaire humorale a été évaluée chez 362 participants (266 dans le groupe IXCHIQ et 96 dans le groupe placebo). Aucun participant n’avait d’anticorps neutralisants anti-CHIKV avant la vaccination. La population étudiée comprenait 82 participants âgés de 65 ans ou plus (59 dans le groupe IXCHIQ et 23 dans le groupe placebo).
VLA1553-321 est une étude contrôlée versus placebo évaluant l’immunogénicité et la sécurité chez des adolescents en bonne santé, âgés de 12 ans à moins de18 ans. L’étude a été réalisée au Brésil qui est un pays endémique pour le chikungunya. Les participants de l’étude ont été suivis pendant 6 mois après l’immunisation. Le critère d’évaluation principal était similaire à celui de l’étude VLA1553-301.
La réponse immunitaire humorale a été évaluée chez 351 participants (303 dans le groupe IXCHIQ et 48 dans le groupe placebo). 293 participants n’avaient pas d’anticorps neutralisants anti-CHIKV contre 58 participants qui en avaient (avant la vaccination).
La persistance des anticorps a été évaluée dans l’étude VLA1553-303 (suivi d’un sous-groupe de participants de l’étude VLA1553-301). Les données sont disponibles jusqu’à 2 ans après l’immunisation. Dans l’étude VLA1553-321, un sous-groupe d’adolescents de 12 ans à moins de 18 ans seront suivis pendant 1 an après l’immunisation.
3. Taux de séroréponse
Adultes
Dans l’étude pivot VLA1553-301, 98,9 % des participants ayant reçu IXCHIQ ont présenté des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 à 28 jours après la vaccination. Ce pourcentage s’est maintenu jusqu’à 6 mois après la vaccination (96,3 %). Voir le Tableau 1. Seulement 1,6 % (n = 4/251) des participants vaccinés avec IXCHIQ avaient des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 au 8ème jour. Aucun participant n’a développé une réponse en anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 dans le groupe placebo de l’étude VLA1553-301.
Tableau 1. Taux de séroréponse en fonction du temps, tel que déterminés par le test μPRNT50 dans l’étude VLA1553-301 (population PP).

Adolescents âgés de 12 ans à moins de 18 ans
Dans l’étude des adolescents VLA1553-321, 98,8 % (248/251) des participants séronégatifs au CHIKV ayant reçu IXCHIQ ont présenté des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 à 28 jours après la vaccination. Ce pourcentage s’est maintenu jusqu’à 6 mois après la vaccination (99,1 % (232/234)). 5,7 % (n = 14/245) des participants séronégatifs au CHIKV vaccinés avec IXCHIQ avaient des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 au 8ème jour. La grande majorité des participants séropositifs au CHIKV (50/52) ont présenté des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 avant la vaccination avec IXCHIQ. Les pourcentages sont restés dans la même fourchette 28 jours après la vaccination (52/52) et 6 mois après la vaccination (45/46).
Tableau 2. Taux de séroréponse en fonction du temps, tel que déterminés par le test µPRNT50 dans l’étude VLA1553-321 (population PP).

4. Persistance des anticorps
La persistance des anticorps a été évaluée 12 et 24 mois après la vaccination dans l’étude VLA1553- 303. Aucun participant n’avait d’anticorps neutralisants anti-CHIKV avant la vaccination.. Le pourcentage de participants ayant des titres d’anticorps neutralisants anti-CHIKV μPRNT50 de ≥ 150 était de 99,5 % (183/184) et de 97,1 % (268/276) respectivement à 1 an et 2 ans après la vaccination.
5. Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec le vaccin IXCHIQ dans un ou plusieurs sous-groupes de la population pédiatrique dans l’immunisation active pour la prévention de la maladie causée par le virus du chikungunya (CHIKV) (voir la rubrique "Posologie" pour les informations concernant l’usage pédiatrique).
Conservation
1. Flacon non ouvert
2 ans.
Ne pas congeler.
2. Après reconstitution
La stabilité en cours d’utilisation du vaccin reconstitué a été démontrée pendant 2 heures lorsqu’il est conservé au réfrigérateur (2 °C – 8 °C) ou à température ambiante (15 °C à 25 °C). Passé ce délai, le vaccin reconstitué doit être jeté.
D’un point de vue microbiologique, après la première ouverture, le vaccin doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur.
3. Précautions particulières de conservation
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver dans l’emballage d’origine à l’abri de la lumière.
Les données de stabilité indiquent que les composants du vaccin sont stables pendant 24 heures dans un flacon non ouvert lorsqu’ils sont conservés à des températures allant de 23 °C à 27 °C. À la fin de ce délai, IXCHIQ doit être utilisé immédiatement ou jeté. Ces données sont destinées à guider les professionnels de la santé en cas d’excursions temporaires de température uniquement, il ne s’agit pas d’une condition de stockage ou d’expédition recommandée.
Pour les conditions de conservation du médicament après reconstitution.
Manipulation
Préparation pour l’administration
Avant l’administration, le vaccin doit être reconstitué uniquement avec le solvant fourni.
Le vaccin reconstitué est une solution liquide claire, incolore à légèrement jaunâtre. Avant l’administration, le vaccin doit être inspecté visuellement pour vérifier l’absence de particules étrangères et de décoloration, lorsque la solution et l’emballage le permettent. En présence de l’un ou l’autre de ces signes, n’administrez pas le vaccin.
Une aiguille (22-25G) d’une longueur d’au moins 40 mm (1 1/2") doit être utilisée pour la reconstitution du vaccin.
La seringue est à usage unique.
 | Figure 1 1) Après avoir retiré le capuchon de la seringue, fixez une aiguille sur l’embout Luer de la seringue. |
 | Figure 2 2) Nettoyez le bouchon du flacon. Transférez lentement la totalité du contenu de la seringue pré-remplie (solvant) dans le flacon (poudre). |
 | Figure 3 3) Agitez doucement le flacon pour dissoudre la poudre. Ne secouez pas et ne retournez pas le flacon. |
 | Figure 4 5) Après la reconstitution, inclinez légèrement le flacon et prélevez la totalité du contenu (0,5 mL) du vaccin reconstitué dans la même seringue. Ne retournez pas le flacon afin de permettre le prélèvement complet du volume reconstitué. |
Après sa reconstitution, administrez IXCHIQ par voie intramusculaire dans les 2 heures. S’il n’est pas utilisé dans les 2 heures, jetez le vaccin reconstitué.
Élimination
Ce produit contient des organismes génétiquement modifiés (OGM).
Tout vaccin non utilisé ou déchet doit être éliminé conformément aux directives locales en matière de déchets pharmaceutiques. Les éclaboussures potentielles doivent être nettoyées immédiatement et désinfectées conformément aux politiques locales. Éliminez les seringues et aiguilles usagées dans un conteneur pour objets tranchants tel qu’un conteneur refermable et résistant aux perforations.
L'administration du vaccin doit être consignée par le médecin sur le carnet de vaccination ou de santé avec le numéro de lot. Il peut aussi être inscrit par le patient ou son médecin sur un carnet de vaccination électronique.
Autres informations
Autorisé le 28 juin 2024 dans les pays de l'Union européenne (également autorisé aux États-Unis depuis novembre 2023 et au Canada depuis juin 2024).
Données de sécurité préclinique
Les données non cliniques issues d’études conventionnelles de toxicité en administration répétée et de toxicité pour la reproduction et le développement n’ont pas révélé de risque particulier pour l’homme.
Un essai de toxicité pour la reproduction réalisé chez des rats femelles avant et après l’accouplement a montré qu’ IXCHIQ n’a pas affecté les paramètres de reproduction, la mise-bas et le développement fœtal ou des petits. Il y avait des indications du passage d’ anticorps spécifiques d’ IXCHIQ dans le placenta et le lait.
IXCHIQ est maintenant autorisé au Royaume-Uni : https://valneva.com/press-release/valneva-receives-marketing-authorization-in-the-uk-for-the-worlds-first-chikungunya-vaccine-ixchiq/?lang=fr
IXCHIQ est maintenant autorisé au Brésil : https://valneva.com/press-release/valneva-receives-first-marketing-authorization-for-ixchiq-in-a-chikungunya-endemic-country/?lang=fr